O Governo está a avaliar as atribuições de entidades como a Direção-Executiva do SNS, a DGS e o Infarmed para garantir “uma articulação virtuosa” que consiga diminuir a burocracia e concretizar as políticas de saúde, anunciou hoje a ministra.


O Governo está a avaliar as atribuições de entidades como a Direção-Executiva do SNS, a DGS e o Infarmed para garantir “uma articulação virtuosa” que consiga diminuir a burocracia e concretizar as políticas de saúde, anunciou hoje a ministra.
Quinze ruturas de ‘stock’ de vacinas foram notificadas ao Infarmed nos últimos três anos, sendo os principais motivos apontados o aumento da procura e problemas de fabrico, anunciou hoje Erica Viegas, do conselho diretivo do Infarmed.

O Infarmed esclareceu esta terça-feira que retirou do seu ‘site’ a informação sobre a suspensão de venda e retirada do mercado de dois cremes com canabidiol porque a decisão ainda é passível de recurso em tribunal.

O Infarmed ordenou a suspensão de comercialização e retirada do mercado de dois cremes com canabidiol, cujo uso é proibido em produtos cosméticos, anunciou a autoridade do medicamento.
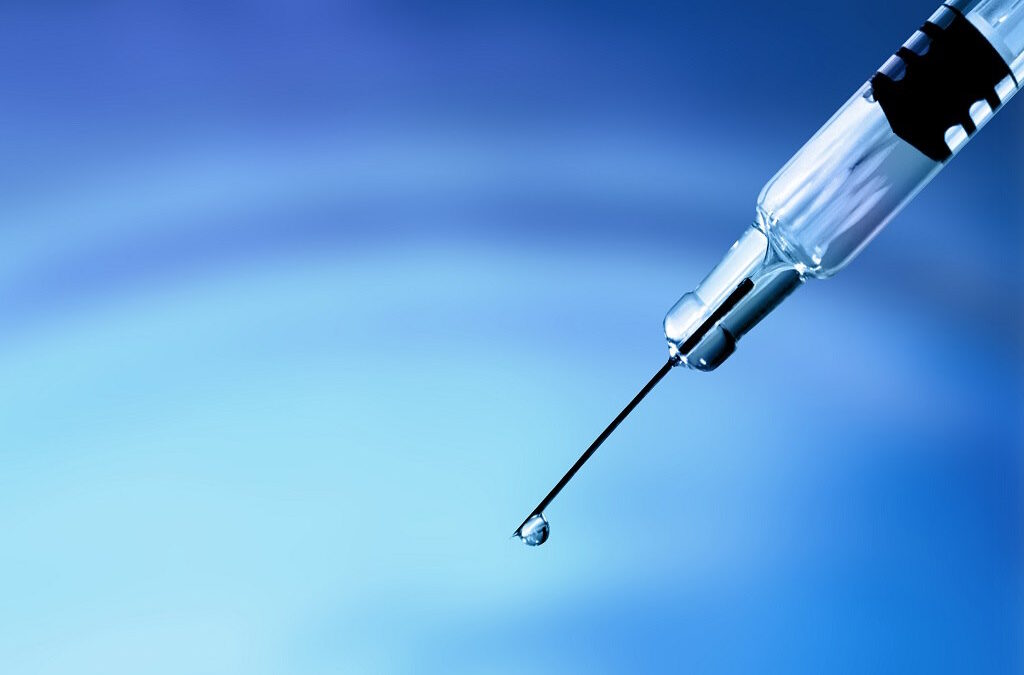
Mais de 110 medicamentos, entre os quais vacinas contra pneumonia, a varicela e a hepatite A e B, estão proibidos para exportação, segundo uma circular informativa da autoridade nacional do medicamento que entra hoje em vigor.

O regulador do medicamento (Infarmed) assegurou que “cumpriu a legislação em vigor em matéria de Autorização de Utilização Excecional” (AUE) de medicamentos no caso das gémeas luso-brasileiras tratadas em Lisboa com um fármaco de milhões de euros.

A Inspeção-Geral das Atividades em Saúde (IGAS) concluiu que o acesso à consulta de neuropediatria das gémeas luso-brasileiras tratadas no Hospital Santa Maria com um medicamento de milhões de euros foi ilegal.

O Infarmed autorizou a utilização do medicamento Colircusi Gentadexa, para tratamento tópico de infeções oculares e auditivas, com rotulagem em espanhol, por rutura de ‘stock’, anunciou a autoridade do medicamento.
A Pfizer anunciou esta terça-feira que o INFARMED autorizou o financiamento do medicamento nirmatrelvir/ritonavir, marca comercial PAXLOVID para tratamento da Covid-19

A Autoridade Nacional do Medicamento e Produtos de Saúde (Infarmed) aprovou este mês três autorizações de colocação no mercado de preparações à base de canábis para fins medicinais, passando a existir quatro produtos farmacêuticos à venda em Portugal.

O Infarmed aprovou três autorizações de colocação no mercado de preparações à base de canábis para fins medicinais, passando a existir quatro produtos farmacêuticos à venda em Portugal, adiantou hoje à Lusa o Infarmed.
A Autoridade Nacional do Medicamento e Produtos de Saúde (Infarmed) acaba de aprovar o financiamento de acalabrutinib para o tratamento de doentes adultos com leucemia linfocítica crónica (LLC) em primeira linha e para doentes adultos com LLC que receberam pelo menos uma linha de tratamento anterior.

A Autoridade Nacional do Medicamento e Produtos de Saúde (Infarmed) reduziu para 98 os medicamentos cuja exportação está temporariamente suspensa, segundo uma circular informativa que entrou em vigor na terça-feira.
A Autoridade Nacional do Medicamento e Produtos (INFARMED) acaba de aprovar o financiamento de Olaparib para tratamento adjuvante de doentes BRCA com cancro da mama precoce de alto risco HER2-negativo, tratamento de doentes BRCA com cancro da próstata metastático resistente à castração e para tratamento de manutenção de doentes BRCA com adenocarcinoma metastático do pâncreas.
A organização Médicos Sem Fronteiras (MSF) ofereceu assistência psicológica às famílias das 98 pessoas que perderam a vida no naufrágio de 07 de abril em Nampula, norte de Moçambique, avançou aquela entidade em comunicado.
Mais de metade dos adolescentes experimentaram álcool e um em cada cinco fumou recentemente cigarros eletrónicos, alertou hoje o Escritório Regional Europeu da Organização Mundial de Saúde (OMS), num relatório sobre hábitos de saúde.
A base da ambulância de emergência médica da Maia do INEM foi assaltada hoje, tendo sido roubados um computador e peças de fardamento do instituto, disse à Lusa fonte o Sindicato dos Técnicos de Emergência Pré-Hospitalar (STEPH).
A farmacêutica AstraZeneca totalizou 2.180 milhões de dólares (cerca de 2.031 milhões de euros) de lucro no primeiro trimestre, mais 20% do que no mesmo período do ano passado.
A Câmara dos Representantes do Arizona aprovou hoje a abolição de uma lei de 1864 que proíbe a quase totalidade dos abortos, considerada aplicável há duas semanas pelo Supremo Tribunal norte-americano.
O Presidente da República, Marcelo Rebelo de Sousa, considera que se deve esperar pelo relatório da atividade da Direção Executiva do Serviço Nacional de Saúde (SNS) que se demitiu, bem como pelas decisões a tomar pelo Governo.

A organização Médicos Sem Fronteiras (MSF) ofereceu assistência psicológica às famílias das 98 pessoas que perderam a vida no naufrágio de 07 de abril em Nampula, norte de Moçambique, avançou aquela entidade em comunicado.

Mais de metade dos adolescentes experimentaram álcool e um em cada cinco fumou recentemente cigarros eletrónicos, alertou hoje o Escritório Regional Europeu da Organização Mundial de Saúde (OMS), num relatório sobre hábitos de saúde.

A base da ambulância de emergência médica da Maia do INEM foi assaltada hoje, tendo sido roubados um computador e peças de fardamento do instituto, disse à Lusa fonte o Sindicato dos Técnicos de Emergência Pré-Hospitalar (STEPH).

A farmacêutica AstraZeneca totalizou 2.180 milhões de dólares (cerca de 2.031 milhões de euros) de lucro no primeiro trimestre, mais 20% do que no mesmo período do ano passado.

A Câmara dos Representantes do Arizona aprovou hoje a abolição de uma lei de 1864 que proíbe a quase totalidade dos abortos, considerada aplicável há duas semanas pelo Supremo Tribunal norte-americano.