![]()
A enzima TBK1 é um componente importante do sistema imunitário inato que desempenha um papel crítico na defesa contra vírus. Após a perda da função TBK1 induzida por mutação, os pacientes mostram uma maior suscetibilidade às infeções virais. Surpreendentemente, se o TBK1 não for de todo expresso, este efeito clínico não é observado. O mecanismo por detrás desta suposta discrepância foi agora desvendado por investigadores do Hospital Universitário de Bona e do Cluster of Excellence ImmunoSensation2, da Universidade de Bona, na Alemanha, liderados pelo Prof. Martin Schlee. O estudo foi publicado na Revista Frontiers in Immunology.
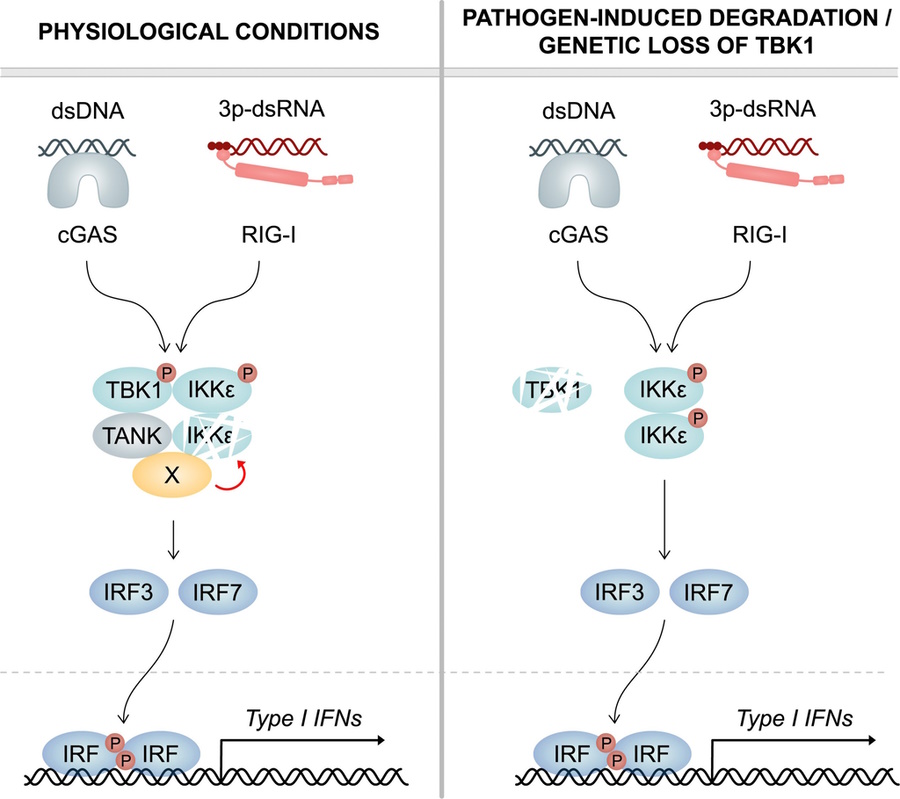
A enzima TBK1 é um componente importante do sistema imunitário inato que desempenha um papel crítico na defesa contra vírus. Após a perda da função TBK1 induzida por mutação, os pacientes mostram uma maior suscetibilidade às infeções virais. Surpreendentemente, se o TBK1 não for de todo expresso, este efeito clínico não é observado. O mecanismo por detrás desta suposta discrepância foi agora desvendado por investigadores do Hospital Universitário de Bona e do Cluster of Excellence ImmunoSensation2, da Universidade de Bona, na Alemanha, liderados pelo Prof. Martin Schlee. O estudo foi publicado na Revista Frontiers in Immunology. No corpo humano, as partículas virais são reconhecidas pelos chamados recetores de reconhecimento de padrões (PRRs) situados dentro da célula ou na superfície da célula. Após a ativação, é iniciada uma cascata de sinalização que resulta, em última análise, na produção e libertação de moléculas de sinalização, tais como interferões e citoquinas. Estas moléculas mensageiras alertam as células imunitárias vizinhas e apontam a infeção viral, induzindo uma reação imunitária. Parte desta cadeia de sinalização é a TANK Binding Kinase 1 (TBK1). Se partículas virais forem detetadas por PRRs, a TBK1 é ativada. A TBK1, por sua vez, ativa dois fatores de transcrição que se deslocam para o núcleo onde induzem a transcrição dos genes do interferão e da citoquina. Suscetibilidade a infeções virais As mutações pontuais no gene TBK1 podem induzir uma perda da função do TBK1. No ser humano, isto manifesta-se em suscetibilidade clínica a infeções virais. Surpreendentemente, este efeito não deve ser observado se o TBK1 não for expresso e faltar completamente na célula. “Surpreendentemente, uma ausência completa de expressão de TBK1 nos seres humanos não está associada a uma resposta antiviral reduzida”, diz o Prof. Martin Schlee do Instituto de Química e Farmacologia Clínica do Hospital Universitário de Bona. Até agora, não era claro porque é que uma perda completa da expressão de TBK1 é melhor tolerada em termos de imunocompetência do que uma mutação de TBK1 que afeta a função quinase. Os investigadores de Bona foram agora capazes de fornecer uma explicação para estas observações anteriormente inexplicadas. “Uma segunda enzima que é muito semelhante ao TBK1 desempenha um papel importante nisto: o epsilon quinase IkB, ou IKKepsilon, para abreviar,” explica Julia Wegner, primeira autora do estudo. Tal como o TBK1, o IKKepsilon atua a jusante dos PRRs e controla a expressão dos interferões. As duas proteínas são também muito semelhantes em estrutura, com mais de 60 por cento de homologia de sequência. Uma descoberta nova é que o TBK1 tem um efeito direto sobre o IKKepsilon. “Nas células mielóides, poderíamos mostrar que o TBK1 regula a expressão da kinase IKKepsilon relacionada,” acrescenta o Dr. Wegner. Sem meias medidas O TBK1 reduz a estabilidade do IKKepsilon. Este processo é independente da função enzimática da proteína. “Assim, o TBK1 que não funciona devido à mutação pontual ainda é capaz de desestabilizar o IKKepsilon”, explica o Prof. Gunther Hartmann, diretor do Instituto de Química Clínica e Farmacologia Clínica e porta-voz do ImmunoSensation2 Cluster of Excellence. “Isto leva a uma degradação contínua da cinase IKKepsilon nas células imunitárias humanas”. Portanto, a perda da expressão TBK1 leva a uma maior abundância do IKKepsilon. Este mecanismo assegura que uma resposta imunitária antiviral pode ocorrer apesar da ausência de TBK1. A perda da função do TBK1 induzida por mutações pontuais, por outro lado, não impede a desestabilização e degradação do IKKepsilon, de modo que, em última análise, ambos os fatores não estão disponíveis para defesa viral. O resultado é o aumento da suscetibilidade às infeções virais. As armas de um vírus Num organismo saudável, o aumento das quantidades de IKKepsilon pode assim compensar a perda de TBK1. Isto torna-se particularmente importante quando os vírus procuram especificamente eliminar as próprias defesas do organismo. O vírus do herpes simplex 1 (HSV-1), vírus da imunodeficiência humana (HIV) e também o coronavírus da síndrome respiratória aguda grave 2 (SARS-CoV-2) são capazes de induzir especificamente a degradação do TBK1. Além disso, várias espécies bacterianas são capazes de causar a degradação do TBK1. “Os nossos dados mostram claramente que as células imunitárias humanas têm um importante mecanismo de salvaguarda (backup)”, explica o Dr. Wegner. “São capazes de manter uma resposta antiviral eficaz mesmo quando ocorre a degradação do TBK1 induzida por agentes patogénicos”. Além disso, o mecanismo também tem efeito em caso de perda genética de TBK1″. Artigo original: Publication: Wegner Julia, Hunkler Charlotte, Ciupka Katrin, Hartmann Gunther, Schlee Martin (2023); Increased IKKepsilon protein stability ensures efficient type I interferon responses in conditions of TBK1 deficiency; Frontiers in Immunology , Vol. 14; DOI: 10.3389/fimmu.2023.1073608
No corpo humano, as partículas virais são reconhecidas pelos chamados recetores de reconhecimento de padrões (PRRs) situados dentro da célula ou na superfície da célula. Após a ativação, é iniciada uma cascata de sinalização que resulta, em última análise, na produção e libertação de moléculas de sinalização, tais como interferões e citoquinas. Estas moléculas mensageiras alertam as células imunitárias vizinhas e apontam a infeção viral, induzindo uma reação imunitária.
Parte desta cadeia de sinalização é a TANK Binding Kinase 1 (TBK1). Se partículas virais forem detetadas por PRRs, a TBK1 é ativada. A TBK1, por sua vez, ativa dois fatores de transcrição que se deslocam para o núcleo onde induzem a transcrição dos genes do interferão e da citoquina.
Suscetibilidade a infeções virais
As mutações pontuais no gene TBK1 podem induzir uma perda da função do TBK1. No ser humano, isto manifesta-se em suscetibilidade clínica a infeções virais. Surpreendentemente, este efeito não deve ser observado se o TBK1 não for expresso e faltar completamente na célula. “Surpreendentemente, uma ausência completa de expressão de TBK1 nos seres humanos não está associada a uma resposta antiviral reduzida”, diz o Prof. Martin Schlee do Instituto de Química e Farmacologia Clínica do Hospital Universitário de Bona. Até agora, não era claro porque é que uma perda completa da expressão de TBK1 é melhor tolerada em termos de imunocompetência do que uma mutação de TBK1 que afeta a função quinase.
Os investigadores de Bona foram agora capazes de fornecer uma explicação para estas observações anteriormente inexplicadas. “Uma segunda enzima que é muito semelhante ao TBK1 desempenha um papel importante nisto: o epsilon quinase IkB, ou IKKepsilon, para abreviar,” explica Julia Wegner, primeira autora do estudo.
Tal como o TBK1, o IKKepsilon atua a jusante dos PRRs e controla a expressão dos interferões. As duas proteínas são também muito semelhantes em estrutura, com mais de 60 por cento de homologia de sequência. Uma descoberta nova é que o TBK1 tem um efeito direto sobre o IKKepsilon. “Nas células mielóides, poderíamos mostrar que o TBK1 regula a expressão da kinase IKKepsilon relacionada,” acrescenta o Dr. Wegner.
Sem meias medidas
O TBK1 reduz a estabilidade do IKKepsilon. Este processo é independente da função enzimática da proteína. “Assim, o TBK1 que não funciona devido à mutação pontual ainda é capaz de desestabilizar o IKKepsilon”, explica o Prof. Gunther Hartmann, diretor do Instituto de Química Clínica e Farmacologia Clínica e porta-voz do ImmunoSensation2 Cluster of Excellence. “Isto leva a uma degradação contínua da cinase IKKepsilon nas células imunitárias humanas”.
Portanto, a perda da expressão TBK1 leva a uma maior abundância do IKKepsilon. Este mecanismo assegura que uma resposta imunitária antiviral pode ocorrer apesar da ausência de TBK1. A perda da função do TBK1 induzida por mutações pontuais, por outro lado, não impede a desestabilização e degradação do IKKepsilon, de modo que, em última análise, ambos os fatores não estão disponíveis para defesa viral. O resultado é o aumento da suscetibilidade às infeções virais.
As armas de um vírus
Num organismo saudável, o aumento das quantidades de IKKepsilon pode assim compensar a perda de TBK1. Isto torna-se particularmente importante quando os vírus procuram especificamente eliminar as próprias defesas do organismo. O vírus do herpes simplex 1 (HSV-1), vírus da imunodeficiência humana (HIV) e também o coronavírus da síndrome respiratória aguda grave 2 (SARS-CoV-2) são capazes de induzir especificamente a degradação do TBK1. Além disso, várias espécies bacterianas são capazes de causar a degradação do TBK1. “Os nossos dados mostram claramente que as células imunitárias humanas têm um importante mecanismo de salvaguarda (backup)”, explica o Dr. Wegner. “São capazes de manter uma resposta antiviral eficaz mesmo quando ocorre a degradação do TBK1 induzida por agentes patogénicos”. Além disso, o m
Artigo original: Publication: Wegner Julia, Hunkler Charlotte, Ciupka Katrin, Hartmann Gunther, Schlee Martin (2023); Increased IKKepsilon protein stability ensures efficient type I interferon responses in conditions of TBK1 deficiency; Frontiers in Immunology , Vol. 14; DOI: 10.3389/fimmu.2023.1073608


0 Comments